在大众认知中,痴呆往往与 “神经退行性变” 划等号 —— 淀粉样蛋白沉积、tau 蛋白缠结、神经元逐渐死亡…… 这些经典机制主导了我们对痴呆的理解。但近年来,一个颠覆性的观点正在兴起:自身免疫可能是认知衰退的 “隐形推手”。
2024 年 7 月发表于《Frontiers in Neurology》的研究《Brain-targeting autoantibodies in patients with dementia》,通过对 161 例痴呆患者的系统分析,首次大规模证实:近 1/5 的痴呆患者体内存在 “脑靶向自身抗体”,这些本应保护身体的免疫武器,正错误地攻击大脑组织。这一发现为痴呆的病因研究和治疗开辟了全新的 “免疫视角”。
自身免疫性疾病的本质是免疫系统 “敌我不分”—— 免疫系统产生的抗体(即 “自身抗体”)错误地攻击人体自身组织。在神经系统中,这种攻击可能导致严重后果:从亚急性脑炎的快速认知崩溃,到慢性痴呆的缓慢衰退。
从“急性脑病” 到 “慢性痴呆” 的 持续时间
过去,自身抗体相关脑病多被认为是 “急性事件”:患者突发癫痫、精神异常或记忆丧失,通过免疫治疗(如激素、血浆置换)可显著缓解。但新研究发现,自身抗体的破坏力具有 “慢性模式”:它们可能在数年甚至数十年间缓慢损伤脑组织,最终表现为与阿尔茨海默病(AD)、血管性痴呆等难以区分的临床症状。
例如,抗 LGI1 抗体患者常因 “顺行性遗忘” 被误诊为 AD,抗 IgLON5 抗体患者可能出现类似 tau 蛋白病的病理改变,却对免疫治疗有反应。这些案例提示:部分 “经典神经退行性痴呆” 可能本质上是自身免疫病。
这项回顾性队列研究通过检测 161 例痴呆患者(涵盖 AD、血管性痴呆、额颞叶痴呆等)和 34 名对照者的血清与脑脊液,绘制出了痴呆相关自身抗体的详细图谱。
1. 近 1/5 患者携带 “脑靶向抗体”,显著高于健康人
研究的核心发现是:21.1% 的痴呆患者(34/161)存在针对脑蛋白的 IgG 型自身抗体,而对照组的检出率仅为 2.9%(1/34)。这一差异强烈提示,这些抗体并非 “随机出现”,而是与痴呆的发生发展密切相关。
值得注意的是,IgA 型自身抗体极为罕见(仅 1 例患者检出),说明IgG 是介导脑损伤的主要 “凶手”。
2. 不同痴呆类型的 “抗体偏好”:血管性痴呆最易受累
自身抗体的分布具有显著的 “亚型特异性”,不同痴呆类型的检出率差异悬殊:
① 血管性痴呆:41.7%(5/12),居所有类型之首;
② 阿尔茨海默病:30%(12/40),印证了 “AD 存在复杂免疫异常” 的既往研究;
③ 不明原因痴呆:25%(1/4),提示自身抗体可能是部分 “疑难病例” 的病因;
④ 主观认知障碍(SCI):16.7%(1/6),意味着抗体可能在认知障碍极早期就已出现;
⑤ 轻度认知障碍(MCI):仅 2.1%(1/48),可能与疾病早期免疫系统尚未被充分激活有关。
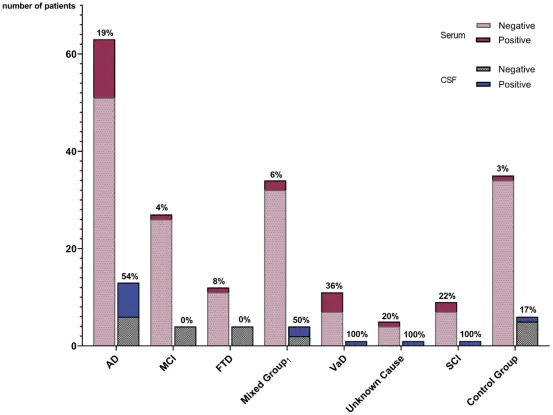
图1:不同诊断组中自身抗体阳性患者的患病率。
各诊断组中阳性患者的百分比分别针对血清和脑脊液给出。(涉及的疾病包括)路易体痴呆、混合性痴呆和淀粉样血管病。AD:阿尔茨海默病;MCI:轻度认知障碍;FTD:额颞叶痴呆;VaD:血管性痴呆;SCI:主观认知障碍;CG:对照组;CSF:脑脊液。
这种 “偏好性” 背后可能存在深层机制:血管性痴呆的高检出率或许与血管内皮损伤、血脑屏障破坏相关 —— 受损的屏障让抗体更容易进入脑组织,而血管本身也可能成为抗体攻击的靶标。
3. 抗体攻击的 “靶标清单”:已知与未知并存
研究发现,这些自身抗体的攻击范围广泛,既有已明确的 “老靶标”,也有尚未被命名的 “新敌人”。
(1)已知靶标:这些脑蛋白已成 “众矢之的”
① 胶质纤维酸性蛋白(GFAP)
GFAP 是星形胶质细胞的 “身份证”,而星形胶质细胞是神经元的 “守护者”—— 负责提供营养、清除废物、维持突触功能。抗 GFAP 抗体的出现,意味着这些 “守护者” 可能被免疫系统破坏,导致神经元失去支持。研究中,AD、血管性痴呆患者均检出该抗体,且既往研究证实,这类患者可能对免疫治疗有反应。
② 甘氨酸受体(GlyR)
甘氨酸受体是大脑中重要的抑制性受体,参与记忆形成和突触可塑性。研究中 2 例 AD 患者检出抗 GlyR 抗体,而既往研究显示,携带该抗体的患者常出现 verbal memory 障碍,脑脊液中 tau 蛋白水平升高 —— 提示抗体可能通过破坏记忆相关通路,间接促进 tau 蛋白异常。
③ Rho GTP 酶激活蛋白 26(ARHGAP26)
这是一种参与细胞信号传导的蛋白,在神经元迁移和突触形成中起关键作用。1 例患者检出该抗体,其可能通过干扰信号通路,影响神经元连接的建立和维持。
图2:天海新域实验室检出ARHGAP26抗体检测图片
④钾通道蛋白(KCNA2)
钾通道是神经元电活动的 “调节器”,KCNA2 抗体可能破坏神经元的电信号传导。研究中 1 例患者检出该抗体,而既往报道显示,这类患者常表现为进行性认知衰退,部分伴随 AD 样脑脊液改变。
⑤其他已知抗体
还包括抗 GABA 受体抗体(影响抑制性神经传递)、抗 Caspr2 抗体(参与轴突功能)等,这些抗体已被证实与癫痫、认知障碍相关。
(2)未知靶标:攻击范围远超想象
更多抗体的靶标尚未明确,但它们的攻击模式已揭示出潜在危害:
①髓鞘靶向抗体(11 例):髓鞘是神经纤维的 “绝缘层”,抗体攻击可能导致信号传导速度减慢,影响大脑各区域的协同工作,在 AD、血管性痴呆患者中均有检出。
② 脑血管及脉络丛靶向抗体(5 例):脉络丛是脑脊液产生的 “工厂”,血管则是血脑屏障的核心。这类抗体可能破坏屏障完整性,让神经毒性物质 “趁虚而入”,这也解释了为何血管性痴呆患者中该类抗体比例最高。
③抗核抗体(ANA)(20.5% 的脑脊液样本):传统认为 ANA 仅攻击细胞核,无致病性,但研究发现,痴呆患者脑脊液中的 ANA 可能进入神经元内,干扰 DNA 复制和修复,通过 “潜伏性损伤” 缓慢破坏认知功能 —— 这一机制被称为 “smoldering humoral autoimmunity”(潜伏性体液自身免疫)。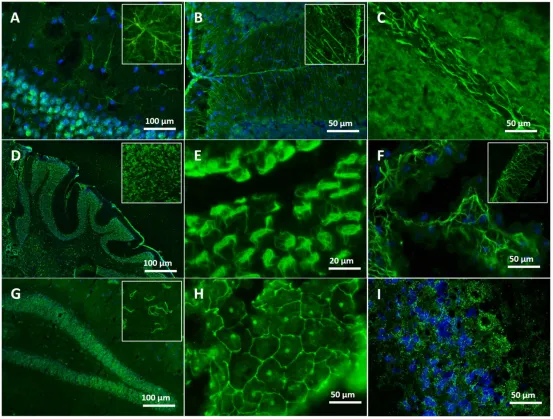
图3:使用不同患者的血清 / 脑脊液在未固定的小鼠脑上呈现的免疫荧光染色模式。
(A)对海马区星形胶质细胞的染色(蓝色:4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)对细胞核的染色)。(B)使用(患者)血清对小脑内伯格曼胶质细胞的特异性标记。(C)使用阿尔茨海默病(AD)患者的脑脊液在小脑深部白质中呈现的强髓鞘染色。(D)使用阿尔茨海默病(AD)患者的血清(染色)的全景显微图像,显示特定区域(蓝色:4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)对细胞核的共染色)。(E)使用阿尔茨海默病(AD)患者的血清对脑室室管膜层的特异性染色。(F)使用阿尔茨海默病(AD)患者的血清在脉络丛中呈现的网状染色。(G)使用阿尔茨海默病(AD)患者的血清在小脑中呈现的广泛抗核抗体(ANA)染色,其中环形和杆状结构的 ANA 染色强度较高。(H)阿尔茨海默病(AD)患者(样本)中,脉络丛细胞呈现类似紧密连接模式的网状标记。(I)使用主观认知障碍(SCI)患者的血清在小脑中呈现的细颗粒状抗核抗体(ANA)染色(蓝色:使用阿尔茨海默病(AD)患者的脑脊液对海马和皮质的共染色)。
4. 抗体阳性患者的特征:更年轻,认知损害程度相似
研究发现,抗体阳性患者的平均年龄(68.3 岁)显著低于阴性患者(73.8 岁),提示自身抗体可能在痴呆病程早期就已启动攻击。
但两组患者在认知损害程度(MMSE 评分)、合并症(如糖尿病、高血压)、脑脊液经典标志物(如 tau 蛋白、β 淀粉样蛋白)等方面无显著差异。这意味着,自身抗体可能是独立于传统病理机制的 “叠加因素”—— 即使淀粉样蛋白沉积不严重,抗体仍可能导致认知衰退。
这项研究不仅揭示了现象,更为临床实践提供了新思路:部分痴呆可能是 “可治疗的自身免疫病”。
1. 谁需要筛查自身抗体?
结合研究结果和临床经验,以下人群应考虑进行自身抗体检测:
① 血管性痴呆患者(41.7% 阳性率,最高风险);
② 不明原因痴呆患者(25% 阳性率,可能为免疫病因);
③ 认知衰退速度较快,或伴随癫痫、睡眠障碍的患者;
④ 传统治疗效果不佳的 AD 患者(30% 可能存在抗体,需排除免疫因素)。
2. 治疗潜力:免疫干预或成新希望
尽管研究未直接评估治疗效果,但既往证据显示,针对自身抗体的免疫治疗可能改善认知功能:
① 激素冲击:抑制过度活跃的免疫系统,减少抗体产生;
② 血浆置换:直接清除血液中的自身抗体;
③ 利妥昔单抗:靶向 B 细胞,从源头减少抗体生成。
例如,抗 LGI1 抗体患者接受免疫治疗后,近半数可恢复独立生活能力;抗 GFAP 抗体相关认知障碍患者经治疗后,MMSE 评分可平均提升 5-8 分。
3. 未来方向:从 “发现抗体” 到 “精准打击”
研究也指出了当前的局限性:多数抗体的靶标尚未明确,致病性仍需验证,检测方法(如未固定脑切片免疫荧光)尚未标准化。未来研究需聚焦:
① 鉴定未知抗原,明确抗体与认知障碍的因果关系;
② 开发更灵敏的检测手段,实现早期诊断;
③ 设计抗体特异性疗法(如单克隆抗体拮抗剂),避免广谱免疫抑制的副作用。
这项研究为我们打开了一扇新窗:痴呆并非全是 “不可逆的神经退行性变”,部分病例可能源于自身免疫异常,而这些病例恰恰是“可治疗” 的。
当我们开始将 “自身抗体检测” 纳入痴呆的常规评估,当针对特异性抗体的靶向治疗进入临床,或许会有越来越多的患者摆脱 “痴呆 = 绝症” 的宿命。免疫系统对大脑的 “错误攻击”,终将被科学精准 “叫停”。

参考文献:Staabs F, et al. Brain-targeting autoantibodies in patients with dementia. Front Neurol. 2024;15:1412813.