2025年12月17日《Neuron》首篇刊登了北京天坛医院国家神经疾病临床研究中心施福东院士的评述,系统阐明以干预星型胶质细胞作为治疗脑卒中和神经疾病的现状、挑战与未来方向。
中星型胶质细胞占比 80% 中枢神经系统的胶质细胞,传统上被视为负责代谢支持、离子稳态维持和突触调控的基础性细胞。随着细胞生物技术的迅速发展,星型胶质细胞的功能范畴不断被认识和扩展。目前认为,星型胶质细胞不仅在生理状态下维持神经网络稳态,更在损伤和疾病过程中承担调控神经免疫、促进血管重塑及参与组织修复等关键任务。尤其在脑卒中这一高度区域化、动态性的病理过程中,星型胶质细胞的反应呈现显著的脑区差异,并深刻影响损伤后的组织重塑与功能恢复。 在同一期《Neuron》发表的文章中,UCLA Carmichael课题组研究了卒中后不同脑区星型胶质细胞的反应差异,尤其揭示皮层与白质星型胶质细胞在血管重塑能力上的显著分化。研究结合多种卒中模型与因果验证表明,皮层星型胶质细胞可通过 Laminin γ1(Lamc1)相关程序驱动血管重塑并促进功能恢复,而白质星型胶质细胞在同一过程中则表现出明显的修复受限特征。这些发现深化了对星型胶质细胞区域异质性的理解。《Neuron》邀请施福东院士从神经发育、代谢和疾病角度, 评价该项研究的理论意义和应用价值,同时就相关领域,从神经疾病治疗视角展开论述。


一、区域异质性的谱系与微环境基础
传统组织学研究曾将星型胶质细胞大致区分为灰质中的原浆型与白质中的纤维型,两者在形态和空间分布上存在明显差异。然而,这种二元分类难以解释星型胶质细胞在不同脑区所表现出的功能差异。近年来的单细胞分析进一步表明,星型胶质细胞在不同脑区表现出的差异,并非仅由形态决定,而是与其发育背景、基因表达特征以及长期所处的局部微环境密切相关。与来源于卵黄囊、在胚胎早期即进入中枢神经系统并维持相对独立谱系的小胶质细胞不同,星型胶质细胞来源于神经上皮细胞,经放射状胶质细胞分化形成,其在发育过程中即逐步形成脑区相关的特征。在此基础上,这些因素共同塑造了皮层、白质、海马和脊髓等区域星型胶质细胞在基因调控、突触支持、增殖潜能和炎症反应方式上的显著不同。例如,皮层星型胶质细胞更侧重于突触功能支持和血管稳态调控,而白质星型胶质细胞则更易呈现前体样状态,在损伤环境中表现出较高的增殖倾向。在炎症条件下,不同脑区星型胶质细胞的反应模式亦存在明显差异。这些观察提示,星型胶质细胞并非功能单一的细胞群体,而是在发育与环境共同作用下形成的高度区域化细胞系统。

二、代谢特征在区域修复差异中的重要作用
在多种可能导致区域差异的因素中,代谢能力的不同被认为是限制白质星型胶质细胞修复潜能的重要原因之一。已有研究显示,白质星型胶质细胞的基础代谢水平明显低于皮层等灰质区域,其 NADH/NAD⁺ 氧化还原状态偏低,胞质 ATP 储备有限,糖酵解及三羧酸循环相关酶的活性亦相对下降。这一代谢特征提示,白质星型胶质细胞在能量供给和生物合成方面处于相对受限的状态,难以满足损伤后组织重建的高能量需求。除基础代谢水平外,谷氨酸代谢的区域差异同样影响星型胶质细胞的能量状态。灰质星型胶质细胞与大量突触紧密接触,需要通过高效的谷氨酸清除和谷氨酰胺合成来维持突触稳态,而这一过程本身即可促进糖酵解并驱动乳酸释放。相比之下,白质区域谷氨酸输入有限,GLT-1 表达水平较低,从而缺乏这一代谢刺激。此外,星型胶质细胞的线粒体功能亦呈现明显的脑区差异,不同区域在动力学调控、钙稳态维持以及损伤应答等方面表现并不一致。综合这些特征可以推测,白质星型胶质细胞相对受限的代谢状态,可能直接制约其在卒中后参与血管生成、基底膜重塑和营养支持等修复过程;而代谢能力更为充足的皮层星型胶质细胞,则更有条件启动并维持持续的修复程序。

三、血管-免疫互作在区域性修复中的调控作用
星型胶质细胞与血管内皮细胞共同构成一个复杂的结构与信号耦联系统,其足突几乎包裹所有脑毛细血管,使其成为维持血脑屏障完整性、调控局部血流的核心细胞。除了通过乳酸等代谢物支持内皮细胞的能量需求外,星型胶质细胞还通过分泌细胞外基质蛋白直接调节血管的稳定性与再生能力。以脑卒中后的修复过程为例,皮层星型胶质细胞通过分泌特定的基底膜成分,能够驱动血管重塑并促进功能恢复;而白质星型胶质细胞在这一过程中则表现出明显的修复受限。血管重塑不仅仅是结构上的改变,它还对免疫环境产生深远影响。血管的通透性和结构变化能够影响外周免疫细胞向脑组织的渗透,从而调节炎症反应的性质和走向。例如,修复相关的淋巴细胞渗入脑组织通常依赖于稳定的血管微环境,而星型胶质细胞通过调控基底膜结构和内皮细胞功能,能够间接引导免疫反应向修复方向转化。
从整体来看,星型胶质细胞并非仅在单一层面参与卒中后的病理过程,而是在血管、代谢和免疫重建等多个环节中发挥协同调控作用,深刻影响损伤后脑组织环境的重塑。

四、星型胶质细胞调控作为治疗策略
在神经系统疾病的连续病程中,小胶质细胞通常表现出更为显著的时间动态性和反应异质性,其激活状态可在不同功能表型之间发生转换,因此较早成为治疗干预的研究重点。近年来,针对小胶质细胞的调控策略在多种疾病中取得了实质性进展。例如,Bruton 酪氨酸激酶抑制剂(BTKI)能同时作用于B细胞和小胶质细胞。HERCULES试验是Tolebrutinib (托莱布替尼)评估非复发型进展型多发性硬化患者残疾进展的全球多中心随机对照双盲试验,结果显示Tolebrutinib可使疾病进展得到减缓,受试者中神经退行性改变呈现缓解趋势(N Engl J Med 2025;392:1883–1892. PMID: 40202696)。该项研究为胶质细胞靶向治疗神经疾病提供了首个证据。
综上,胶质细胞并非静态的支持性细胞,而是可通过药物和信号通路进行调控的动态细胞群体(图)。尽管与小胶质细胞相比,星型胶质细胞在疾病进程中表现出的时间动态性相对有限,但其在代谢耦联、血管稳态维持以及免疫调控等方面承担着更具结构性和整合性的功能,使其在组织修复中的作用难以被其他细胞类型所替代,如果能够在合适的时间窗口内调动星型胶质细胞的内在修复潜能,使其功能朝向有利于组织重建和内源性神经修复的方向转变,其治疗价值值得进一步探索。
然而,将星型胶质细胞调控真正转化为可应用的临床治疗策略仍面临多方面挑战。首先,其区域性特征突出、功能类型多样,使得不同脑区、不同病程阶段的星型胶质细胞具有高度多维的反应模式,因此需要在时间和空间特异性的框架内重新评估候选靶点。其次,尽管近年来已出现针对星型胶质细胞代谢特征的分子示踪剂11C-actate/18F-FDG(如在阿尔茨海默病研究中应用的相关 PET 示踪策略),其特异性、灵敏度及对功能状态的区分能力仍有待结合人脑神经病理和相应细胞及类器官模型等进一步验证。此外,如何在不干扰星型胶质细胞维持正常脑稳态功能的前提下实现治疗性调控,也是未来转化研究中亟需解决的问题。
总体而言,干预小胶质细胞在多发性硬化中的初步成功经验不仅为脑卒中等神经疾病提供了可借鉴的途径,也提示我们,星型胶质细胞作为神经修复的关键环节,其治疗潜力值得被系统性挖掘。
参考文献:扫码下载两篇原文

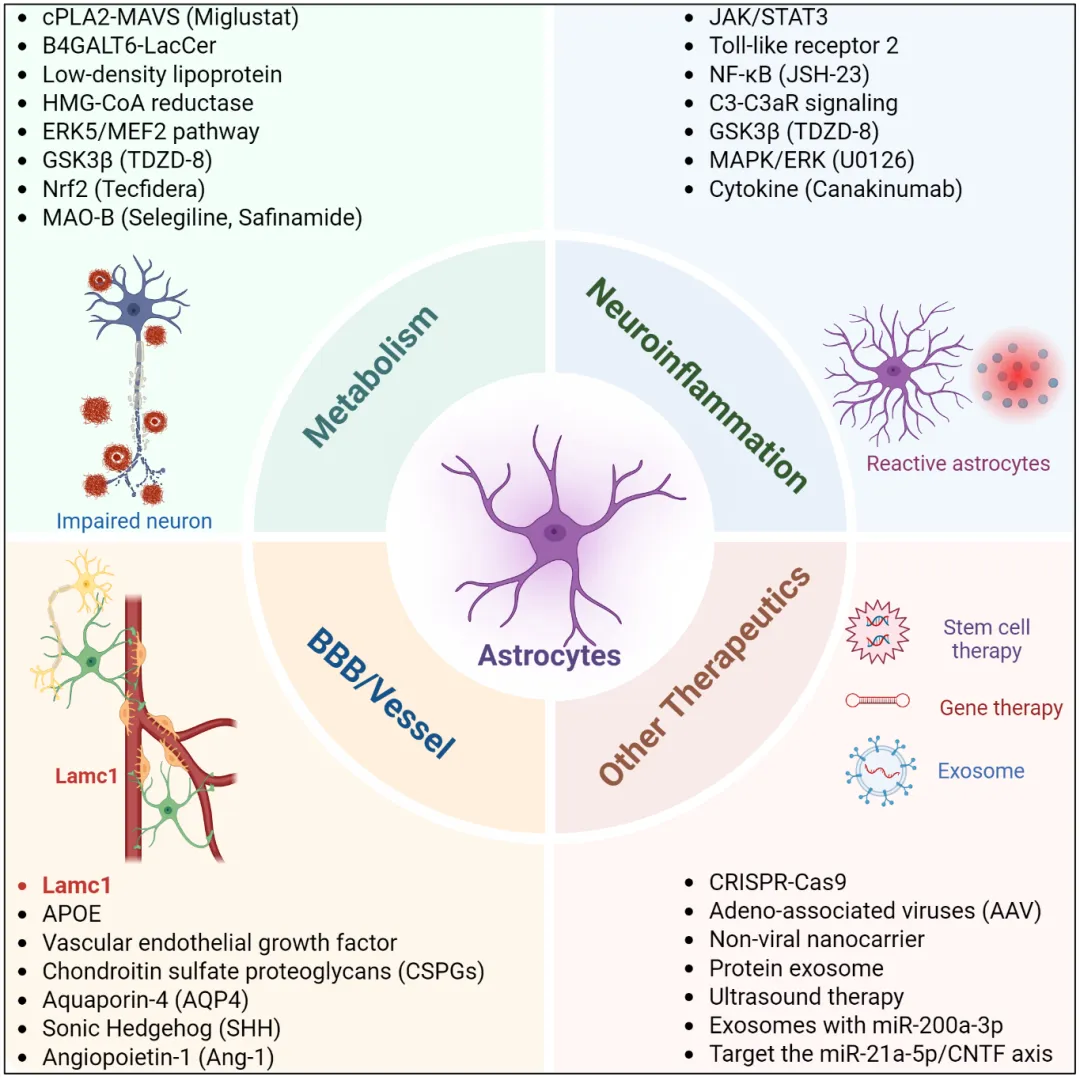
图1. 星型胶质细胞从代谢、血管、免疫等角度调控以治疗神经系统疾病的潜在策略
作者简介:
施福东,北京天坛医院神经免疫科/神经系统疾病国家临床医学研究中心/天津总医院神经科主任,欧洲科学院院士,聚焦神经免疫疾病的诊治,基于其课题组长期和深入的原创性研究成果,奠定神经病学和临床神经科学多项理论基础,对神经疾病诊治产生了前瞻型影响。
表:观点性论文和综述所承载的施福东院士对神经免疫领域理论和疾病诊治的部分贡献
