先搞懂:PLP1蛋白——
髓鞘的“核心建材”
要理解PLP1抗体的意义,得先认识它的“靶标”——PLP1蛋白。
PLP1是中枢神经系统(CNS)髓鞘中含量最高的蛋白质,占髓鞘总蛋白的50%,堪称髓鞘的“核心结构件”:少突胶质细胞能靠它搭建并维持髓鞘的紧密结构,而髓鞘又是保护神经轴突、保证信号传导的关键“绝缘层”。
更特别的是,PLP1基因会通过“可变剪接”生成两种关键蛋白:
PLP1:主要分布在中枢神经系统(大脑、脊髓),是维持中枢髓鞘稳定、保护轴突功能的“主力”;
DM20:比PLP1少了一段胞内片段,主要存在于外周神经系统(如四肢神经)的施旺细胞中,负责外周髓鞘的健康。
这种“中枢+外周双位点表达”的特性,为后续PLP1抗体导致“中枢与外周同时受损”埋下了伏笔——比如部分CCPD患者同时出现视神经炎、脊髓炎和周围神经病变,正是PLP1/DM20的分布特点在“作祟”。
PLP1抗体:从“争议”到“精准
检测”,技术突破是关键
其实早年间,研究者就曾在MS患者血清中发现过PLP1抗体的痕迹,但结果却“矛盾重重”:不同研究中阳性率从1%到70%不等,根本无法作为诊断依据。
问题出在哪?检测方法没找对。早期检测依赖“线性表位”或“非构象依赖性实验”,无法识别天然状态下PLP1蛋白的真实结合位点——就像把“完整的钥匙”拆成碎片,自然打不开“锁”(抗体结合位点)。
直到近期发表在《Neurology: Neuroi-mmunology & Neuroinflammation》的多中心研究,才找到破解之道:构象依赖性检测。这一技术革新让PLP1抗体的检测终于“精准化”,核心包括三个关键步骤(图1):
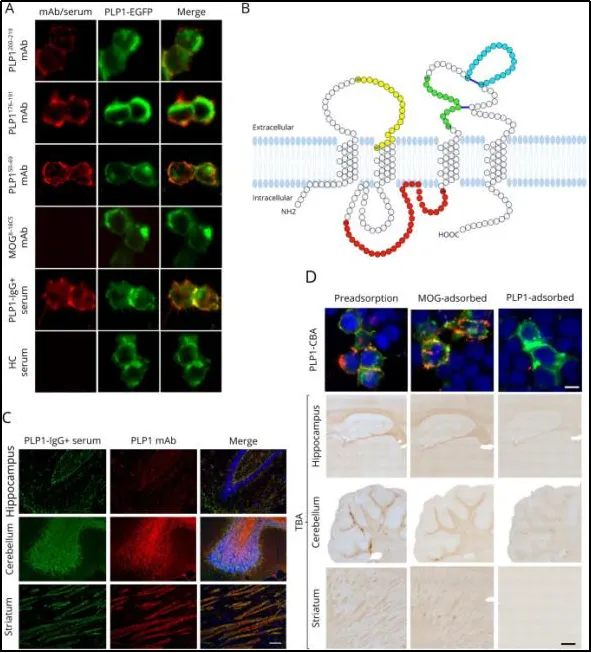
图1.构象依赖性PLP1表位是髓磷脂抗体的靶抗原
1. 构象依赖性细胞基因转染检测(CBA)
把完整的PLP1基因转入HEK293T细胞,让PLP1蛋白保持天然构象。实验证实,PLP1抗体只认“天然构象的PLP1”——一旦细胞被固定处理、构象改变,抗体信号就会消失。更关键的是,在1100余例脱髓鞘病患者和177名健康对照中,对照组全为阴性,特异性极高。
2.组织学验证
PLP1抗体阳性的血清,能在轻度固定的大鼠脑组织上“精准染色”,且染色位置与PLP1单克隆抗体完全重合,进一步确认了靶向性。
3. 亚类分析与功能实验
PLP1抗体主要是IgG1/IgG3亚型——这两种亚型能激活“补体系统”,通过补体依赖性细胞毒性(CDC)攻击细胞。这意味着,PLP1抗体不是“旁观者”,而是能直接导致组织损伤的“致病抗体”。
PLP1抗体阳性,常对应哪些
“疑难病”?临床特征一目了然
随着检测技术的成熟,研究者逐渐摸清了PLP1抗体的“偏好”——它尤其容易出现在四类“疑难脱髓鞘病”中,且每类都有鲜明特征:
1. 中枢-外周联合脱髓鞘(CCPD):
PLP1抗体的“核心靶点”
CCPD是最典型的“PLP1相关疾病”——这类患者同时出现中枢(如脊髓炎、脑脊髓炎)和外周神经(如肢体麻木、无力)症状,过去因缺乏标志物难以确诊。
研究发现,24.1%的CCPD患者PLP1抗体阳性,且几乎所有阳性患者都会同时识别PLP1(中枢)和DM20(外周)——完美匹配其“双位点损伤”的表现。影像学上,这些患者的脊髓锥体或脊神经根常出现增强信号;神经传导检查也会提示外周神经脱髓鞘改变,与临床症状高度吻合。
2. MOGAD:
阳性者病情更重,易合并外周损伤
MOGAD本身是较明确的疾病谱系,但部分患者会出现“异质性”——比如病情更重、恢复更差。研究发现,约8.3%的MOGAD患者PLP1抗体阳性,且这一亚群有明显特点:
扩展残疾状态量表(EDSS)评分更高(提示残疾更严重);
残疾恢复不全的比例更高;
更易合并外周神经受累(这是典型MOGAD少见的表现)。
这提示,PLP1抗体可能是MOGAD“表型不一”的关键原因之一——阳性患者往往需要更积极的治疗。
3. 非典型MS:
帮你区分“类MOGAD”亚型
典型MS患者中,PLP1抗体阳性率仅1.4%;但在“非典型MS”(症状、影像不符合经典MS表现)患者中,阳性率骤升至21.2%。
更重要的是,这些阳性患者的影像学特征更像MOGAD:比如双侧视神经炎、视交叉受累、长节段脊髓炎(LETM)、肿块样脱髓鞘灶(TDL)——这为“类MOGAD表型的MS”提供了关键解释,避免误诊为普通MS而延误治疗。
4. 血清学阴性NMOSD:
12%阳性,找到“隐性致病抗体”
部分NMOSD患者AQP4、MOG抗体均为阴性(即SN-NMOSD),长期找不到致病原因。研究发现,约12%的SN-NMOSD患者PLP1抗体阳性,其中部分人还会合并外周神经受累。
这就像为SN-NMOSD患者找到了“隐性标志物”——类似MOG抗体重新定义AQP4阴性NMOSD,PLP1抗体也有望将一部分SN-NMOSD归入“明确抗体阳性”的范畴,让治疗更有方向。
PLP1抗体:不只是“标志物”,
更是“致病元凶”之一
PLP1抗体之所以重要,不仅因为它能“指路”诊断,更因为它直接参与了疾病发生——是名副其实的“致病抗体”,主要通过三种方式造成损伤:
1. 补体介导的“精准攻击”
PLP1抗体多为IgG1/IgG3亚型,能激活人体的“补体系统”(免疫系统的“攻击武器”),通过补体依赖性细胞毒性(CDC)直接破坏表达PLP1的髓鞘细胞。体外实验证实,阳性血清能显著降低PLP1转染细胞的存活率,且这种损伤必须依赖补体存在。
2. “双靶点打击”
同时伤中枢和外周:由于PLP1(中枢)和DM20(外周)共享胞外结构域,PLP1抗体会“一视同仁”地攻击两者——这正是CCPD患者“中枢+外周同时受累”的核心机制。
3. 鞘内合成,持续“搞破坏”
研究者在患者脑脊液中发现了能分泌PLP1特异性抗体的克隆性B细胞,说明这种抗体不仅存在于血液中,还能在中枢神经系统内“就地合成”,持续引发炎症和脱髓鞘。动物实验也证实,PLP1抗体会加重实验性自身免疫性脑脊髓炎(EAE)的病变,进一步验证了其致病性。
对临床而言,PLP1抗体
有什么“实际用处”?
PLP1抗体的发现,不是“实验室里的理论突破”,而是能直接落地临床、帮医生和患者解决实际问题的“工具”,核心价值体现在三方面:
1. 破解“抗体阴性”困境,精准诊断
对那些反复出现脱髓鞘症状、但AQP4/MOG抗体全阴性的患者,PLP1抗体检测能提供“新答案”——尤其是CCPD、非典型MS、SN-NMOSD患者,检测PLP1抗体可帮助明确分型,避免“无的放矢”的治疗。
2. 提示预后:阳性=病情更重,
需更早干预
研究证实,PLP1抗体阳性患者的预后普遍更差:MS和MOGAD中,阳性者的MS严重程度评分(MSSS)、EDSS评分显著高于阴性者,残疾积累更快、恢复更难。这意味着,一旦检测阳性,医生可更早启动“强化免疫治疗”,延缓残疾进展。
3. 指导治疗:指向“抗补体”
“耗竭B细胞”新方向
由于PLP1抗体的致病依赖补体激活和B细胞分泌,它为治疗提供了“精准靶点”:
可尝试“抗补体治疗”:如使用C5抑制剂(依库珠单抗、拉武珠单抗等),阻断补体介导的损伤;
对复发频繁、疗效差的患者,早期使用“B细胞耗竭治疗”(如抗CD20单抗),减少抗体合成。
未来,PLP1抗体检测有望纳入神经免疫病“常规抗体谱”,让治疗从“经验性”走向“个体化”。
未来可期
尽管PLP1抗体的研究已取得突破,但仍有不少“待解之谜”:
人群差异:不同种族、地区的患者,PLP1抗体阳性率是否有区别?儿童与成人患者的表现是否一致?
发病机制:除了补体途径,PLP1抗体是否还有其他“破坏路径”?是否存在特定基因(如HLA)让人群更易产生PLP1抗体?
靶向治疗:目前针对PLP1阳性患者的特异性治疗临床试验尚未开展,未来需验证抗补体、B细胞耗竭等方案的疗效。
总结
PLP1抗体的发现,不仅为CCPD、非典型MS、SN-NMOSD等“疑难脱髓鞘病”找到了病理学依据,更填补了神经免疫病“抗体检测空白”。对临床而言,它既是“诊断指南针”,能破解“阴性患者”的困境;也是“预后信号灯”,提示病情严重程度;更是“治疗导航仪”,指向更精准的干预方向。
随着检测技术的普及和多中心研究的推进,未来PLP1抗体必将成为神经免疫病诊疗的“常规武器”——让更多曾被“模糊诊断”的患者,找到属于自己的“精准治疗方案”。
END
关联项目:
天海新域实验室已推出PLP1抗体检测项目,仅需0.2ml血清/脑脊液,即可检测,同时提可供抗体亚型检测,供临床选择。

参考文献:Masciocchi S, Businaro P, Greco G, et al. Conformational Antibodies to Proteolipid Protein-1 and Its Peripheral Isoform DM20 in Patients With CNS Autoimmune Demyelinating Disorders. Neurol Neuroimmunol Neuroinflamm. 2025 Mar;12(2):e200359.